 細(xì)胞培養(yǎng)進(jìn)口血清進(jìn)口胎牛血清進(jìn)口新生牛血清進(jìn)口豬血清馬血清
細(xì)胞培養(yǎng)進(jìn)口血清進(jìn)口胎牛血清進(jìn)口新生牛血清進(jìn)口豬血清馬血清 支原體檢測(cè)盒及標(biāo)準(zhǔn)品常規(guī)PCR檢測(cè)試劑盒熒光定量PCR檢測(cè)(qPCR法)支原體DNA提取靈敏度標(biāo)準(zhǔn)品(方法驗(yàn)證用)特異性標(biāo)準(zhǔn)品(方法驗(yàn)證用)PCR定量標(biāo)準(zhǔn)品(可用于方法驗(yàn)證)
支原體檢測(cè)盒及標(biāo)準(zhǔn)品常規(guī)PCR檢測(cè)試劑盒熒光定量PCR檢測(cè)(qPCR法)支原體DNA提取靈敏度標(biāo)準(zhǔn)品(方法驗(yàn)證用)特異性標(biāo)準(zhǔn)品(方法驗(yàn)證用)PCR定量標(biāo)準(zhǔn)品(可用于方法驗(yàn)證) 支原體祛除試劑細(xì)胞中支原體祛除環(huán)境支原體祛除水槽支原體祛除
支原體祛除試劑細(xì)胞中支原體祛除環(huán)境支原體祛除水槽支原體祛除 干細(xì)胞培養(yǎng)基
干細(xì)胞培養(yǎng)基 DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監(jiān)測(cè)
DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監(jiān)測(cè) RNA病毒研究試劑RNA病毒檢測(cè)試劑盒病毒RNA提取
RNA病毒研究試劑RNA病毒檢測(cè)試劑盒病毒RNA提取 PCR儀器及配套產(chǎn)品DNA污染監(jiān)測(cè)祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預(yù)混液(凍干粉)熱啟動(dòng)聚合酶MB Taq DNA
PCR儀器及配套產(chǎn)品DNA污染監(jiān)測(cè)祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預(yù)混液(凍干粉)熱啟動(dòng)聚合酶MB Taq DNA 微生物PCR檢測(cè)食品檢測(cè)類(lèi)產(chǎn)品食品微生物檢測(cè)細(xì)菌PCR檢測(cè)
微生物PCR檢測(cè)食品檢測(cè)類(lèi)產(chǎn)品食品微生物檢測(cè)細(xì)菌PCR檢測(cè)
- 細(xì)胞培養(yǎng)進(jìn)口血清進(jìn)口胎牛血清進(jìn)口新生牛血清進(jìn)口豬血清馬血清
- 支原體檢測(cè)盒及標(biāo)準(zhǔn)品常規(guī)PCR檢測(cè)試劑盒熒光定量PCR檢測(cè)(qPCR法)支原體DNA提取靈敏度標(biāo)準(zhǔn)品(方法驗(yàn)證用)特異性標(biāo)準(zhǔn)品(方法驗(yàn)證用)PCR定量標(biāo)準(zhǔn)品(可用于方法驗(yàn)證)
- 支原體祛除試劑細(xì)胞中支原體祛除環(huán)境支原體祛除水槽支原體祛除
- 干細(xì)胞培養(yǎng)基
- DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監(jiān)測(cè)
- RNA病毒研究試劑RNA病毒檢測(cè)試劑盒病毒RNA提取
- PCR儀器及配套產(chǎn)品DNA污染監(jiān)測(cè)祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預(yù)混液(凍干粉)熱啟動(dòng)聚合酶MB Taq DNA
- 微生物PCR檢測(cè)食品檢測(cè)類(lèi)產(chǎn)品食品微生物檢測(cè)細(xì)菌PCR檢測(cè)
|
|
蛋白質(zhì)組學(xué)再立戰(zhàn)功:揭示了BCAT1在癌細(xì)胞轉(zhuǎn)移中的重要作用2021-12-03 14:38來(lái)源:威正翔禹|締一生物
癌癥是對(duì)人類(lèi)健康威脅**的疾病之一。根據(jù)世界衛(wèi)生組織(WHO)的統(tǒng)計(jì),2018 年全球新發(fā)癌癥病例達(dá)到 1,807 萬(wàn)例,其中肺癌 209 萬(wàn)例,發(fā)病率名列前茅。
中國(guó)癌癥新發(fā)患者人數(shù)也在逐年增加,根據(jù)國(guó)家癌癥中心發(fā)布的全國(guó)最新癌癥數(shù)據(jù),2015 年全國(guó)新發(fā)惡性腫瘤病例數(shù)約 392.9 萬(wàn)例,肺癌位居發(fā)病首位。
 肺癌患病率逐年攀升,轉(zhuǎn)移是肺癌高死亡率的主要原因之一,嚴(yán)重危害人類(lèi)公共健康。 肺癌是如何轉(zhuǎn)移的? 哪些因素會(huì)影響肺癌轉(zhuǎn)移? 如何斷了癌細(xì)胞后路,避免其轉(zhuǎn)移? 這些問(wèn)題一直困擾著研究人員。 近日,《Theranostics》上發(fā)表了一篇標(biāo)題為:“Proteomic analysis of lung cancer cells reveals a critical role of BCAT1 in cancer cell metastasis”的論文,或許可以在一定程度上回答上述問(wèn)題。  圖片來(lái)源:https://www.thno.org/v11p9705.htm 點(diǎn)擊文末閱讀原文,即可獲得完整文獻(xiàn) 濃縮精華版: 研究人員發(fā)現(xiàn):在轉(zhuǎn)移性肺癌細(xì)胞和肺癌患者的轉(zhuǎn)移性組織中,分支鏈氨基酸代謝的關(guān)鍵酶BCAT1蛋白水平呈現(xiàn)過(guò)表達(dá)狀態(tài)。通過(guò)數(shù)據(jù)分析分析得出結(jié)論:BCAT1轉(zhuǎn)錄的增加,與肺癌患者總生存率較低之間存在關(guān)聯(lián)性。 感興趣的小伙伴可以接著往下看,有詳細(xì)版。  在過(guò)去的十年中,基因組測(cè)序越來(lái)越多地被應(yīng)用到轉(zhuǎn)移性腫瘤突變譜的研究中 [1,2]。已有一些研究,對(duì)肺癌患者標(biāo)本進(jìn)行了全面的蛋白質(zhì)基因組學(xué)研究,繪制了呈現(xiàn)了原發(fā)腫瘤相對(duì)于腫瘤旁“正常”組織的蛋白質(zhì)組圖 [3,4]。然而,關(guān)于轉(zhuǎn)移性肺癌的蛋白質(zhì)組水平的相關(guān)研究仍然不足。 我們已經(jīng)知道,氨基酸代謝在腫瘤發(fā)生和轉(zhuǎn)移中起重要作用。  氨基酸密碼子對(duì)照表 支鏈氨基酸(BCAA)到α-酮戊二酸(α-KG)的轉(zhuǎn)氨基反應(yīng),由胞質(zhì)BCAT1和線粒體BCAT2兩種類(lèi)型的bcat基因催化。該反應(yīng)產(chǎn)生谷氨酸,而谷氨酸又可以被腫瘤細(xì)胞優(yōu)先利用以促進(jìn)生存[5]。 點(diǎn)擊下方小程序 了解細(xì)胞培養(yǎng)相關(guān)血清產(chǎn)品詳情
由此得到的支鏈酮酸(BCKA)進(jìn)一步分解為乙酰輔酶A和琥珀酰輔酶A,它們是TCA循環(huán)的中間體[6]。BCAT1的過(guò)表達(dá)與髓樣白血病[7]、膠質(zhì)瘤[8]和非小細(xì)胞肺癌[9]的癌癥進(jìn)展有關(guān),而增加BCAA攝取對(duì)于維持NSCLC[10]的腫瘤發(fā)生很重要。然而,BCAT1的表達(dá)過(guò)程,是否在轉(zhuǎn)移性腫瘤中出現(xiàn)紊亂?在潛在的遷移過(guò)程中發(fā)揮作用?這些目前尚不清楚。 為了確定與肺癌轉(zhuǎn)移狀態(tài)相關(guān)的蛋白質(zhì)組學(xué)的變化,研究人員用到了一種同位素標(biāo)記(SILAC:細(xì)胞培養(yǎng)穩(wěn)定同位素標(biāo)記,在細(xì)胞培養(yǎng)過(guò)條件下,用含有輕、重同位素標(biāo)記氨基酸的培養(yǎng)基,進(jìn)行細(xì)胞培養(yǎng),若干代后,細(xì)胞中的蛋白質(zhì)被穩(wěn)定標(biāo)記上同位素)的定量質(zhì)譜分析。 利用原發(fā)性肺腺癌A549細(xì)胞系(指定L0)和L0細(xì)胞進(jìn)行了三輪BALB/c Nude小鼠體內(nèi)選擇,產(chǎn)生脊柱轉(zhuǎn)移細(xì)胞(指定L2和L6)[11]。然后,分別在“輕、中、重”三種同位素標(biāo)記的培養(yǎng)基進(jìn)行培養(yǎng),穩(wěn)定標(biāo)記后進(jìn)行質(zhì)譜定量分析。 得到結(jié)果1
隨后,作者又比較分析了四對(duì),來(lái)自腫瘤患者樣本的原發(fā)和轉(zhuǎn)移性腫瘤組織進(jìn)行蛋白質(zhì)組學(xué)。 采用串聯(lián)質(zhì)譜(TMT)標(biāo)記和質(zhì)譜定量分析方法檢測(cè)蛋白表達(dá),利用TCGA數(shù)據(jù)進(jìn)行分析。 得到結(jié)果2
接著,研究人員利用A549細(xì)胞系,進(jìn)行了一系列細(xì)胞學(xué)實(shí)驗(yàn)以及分子實(shí)驗(yàn):Western blot、trans-well、RNA干擾等,以及小鼠體內(nèi)實(shí)驗(yàn),進(jìn)一步探究BCAT1在轉(zhuǎn)移中的作用。 說(shuō)到細(xì)胞培養(yǎng),自然離不開(kāi)動(dòng)物血清,Ausbian進(jìn)口特級(jí)胎牛血清,內(nèi)毒素低(≤3EU/ml),品質(zhì)穩(wěn)定,點(diǎn)擊下方小程序了解更多產(chǎn)品詳情。
得到結(jié)果3
為了深入了解BCAT1介導(dǎo)的轉(zhuǎn)移的機(jī)制,研究人員檢測(cè)了與干細(xì)胞和上皮-間質(zhì)轉(zhuǎn)化(EMT)相關(guān)基因的表達(dá)。 得到結(jié)果4
SOX2是維持胚胎干細(xì)胞和腫瘤干細(xì)胞可塑性的轉(zhuǎn)錄因子,它的過(guò)表達(dá)促進(jìn)了肺癌的轉(zhuǎn)移。在已有研究中,SOX2的表達(dá)增加可能會(huì)使L0細(xì)胞進(jìn)入低分化狀態(tài),遷移能力增加。 文章作者從先前的研究[11]中重新分析了這些A549細(xì)胞的RNA-seq數(shù)據(jù)。 得到結(jié)果5
然而,在先前的SILAC實(shí)驗(yàn)結(jié)果中,轉(zhuǎn)移細(xì)胞中包括CTNNB1和DVL2在內(nèi)的Wnt信號(hào)蛋白減少。He等人之前的一項(xiàng)研究也表明,過(guò)表達(dá)SOX2可能通過(guò)上調(diào)A549細(xì)胞[12]中的GSK3β,導(dǎo)致Wnt/β-catenin信號(hào)通路的抑制。 因此,作者假設(shè)SOX2通過(guò)β-catenin抑制Wnt信號(hào),維持轉(zhuǎn)移細(xì)胞的未分化狀態(tài)。 為了驗(yàn)證這一假設(shè),研究人員用幾種不同的方式:熒光成像、流式細(xì)胞術(shù)、Western blot、Real-time PCR,確定了BCAT1在轉(zhuǎn)移性A549細(xì)胞中促進(jìn)了SOX2的表達(dá),這一新的途徑可能是肺癌細(xì)胞干性的重要調(diào)控因子。 得到結(jié)果6
TET2調(diào)控的許多基因中有編碼micro-RNAs的基因,已有研究表明miR200家族成員是SOX2的負(fù)調(diào)控因子。 這提出了一種可能性: 即bcat介導(dǎo)的α-KG的減少導(dǎo)致miR200家族成員的高甲基化,并解除了SOX2的翻譯抑制。 分析顯示miR200c的表達(dá)與BCAT1呈負(fù)相關(guān)。 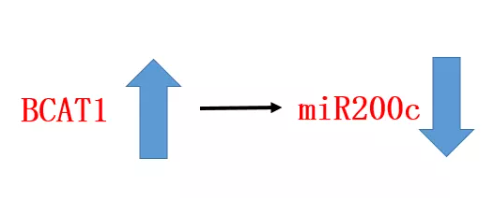 有報(bào)道稱:miR-200c表達(dá)的丟失在NSCLC中誘導(dǎo)了侵襲性表型。研究人員測(cè)量了miR200c,以及其他后續(xù)實(shí)驗(yàn)。 得到結(jié)果7
因此,研究人員認(rèn)為: BCAT1-α-KG-miR200c-SOX2 調(diào)控途徑成立! 綜上所述,研究發(fā)現(xiàn)BCAT1在轉(zhuǎn)移性肺癌細(xì)胞中表達(dá)上調(diào),調(diào)控其遷移轉(zhuǎn)移,并與不良預(yù)后相關(guān)。該研究確定了一條新的通路,其中α-KG是轉(zhuǎn)移性肺癌細(xì)胞中BCAT1和SOX2表達(dá)轉(zhuǎn)錄后調(diào)控之間的關(guān)鍵代謝信號(hào)傳導(dǎo)中間體。 這些發(fā)現(xiàn)可能為靶向肺癌轉(zhuǎn)移過(guò)程的治療開(kāi)辟新的策略。 如果你對(duì)本公司產(chǎn)品感興趣,想要了解更多,歡迎訪問(wèn) 北京締一生物官網(wǎng):www.dyshengwu.com 或聯(lián)系北京締一生物公司 咨詢熱線: 400-166-8600 010-84118494 021-64186645 13811167915 咨詢QQ: 1580434811 咨詢QQ: 1258888686 客服郵箱:servicebj@viansaga.com 客服郵箱:servicesh@viansaga.com 聲明:本網(wǎng)站所有注明“來(lái)源:締一生物”的內(nèi)容,版權(quán)均屬于北京締一生物網(wǎng)站所有,受到知識(shí)產(chǎn)權(quán)的法律保護(hù)。如需引用、轉(zhuǎn)載,須注明來(lái)源及原文鏈接。如內(nèi)容涉及實(shí)質(zhì)性修改,須來(lái)電獲取書(shū)面授權(quán),且轉(zhuǎn)載時(shí),須注明“來(lái)源:締一生物”。 最終解釋權(quán)歸締一生物所有。
|
 細(xì)胞培養(yǎng)進(jìn)口血清
細(xì)胞培養(yǎng)進(jìn)口血清 支原體祛除試劑
支原體祛除試劑 干細(xì)胞培養(yǎng)基
干細(xì)胞培養(yǎng)基



